Capaz de identificar no sangue a presença dos vírus da Aids e da hepatite C nos períodos de janela imunológica – intervalo de tempo entre a infecção e a produção de anticorpos pelo organismo – o teste molecular Kit NAT HIV/HCV evita transfusões de sangue contaminado. Um total de 3 milhões de amostras de bolsas de sangue de doadores já foram testadas desde 2011 em 14 hemocentros do país com o Kit NAT. Desenvolvido pelo Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos/Fiocruz) em colaboração com o Instituto de Biologia Molecular do Paraná (IBMP), a Universidade Federal do Rio de Janeiro (UFRJ) e alguns hemocentros, o produto pioneiro foi uma encomenda do Ministério da Saúde para auxiliar na triagem de doadores de sangue e complementar os testes convencionais (sorológicos), aumentando a segurança transfusional nos hemocentros brasileiros.
Registrado pela Agência Nacional de Vigilância Sanitária (Anvisa), o Kit NAT é um teste de ácido nucléico que permite detectar o material genético dos vírus, possibilitando uma redução significativa no período denominado como janela imunológica, o que não ocorre com os outros testes sorológicos utilizados na triagem de doadores de sangue. A plataforma do Kit NAT congrega três equipamentos e cinco softwares, que funcionam de forma integrada e oferecem grande capacidade de processamento: mais de mil amostras de sangue de doadores por dia, em duas ou três rotinas com até 552 bolsas de sangue cada.
De acordo com o gerente do Programa de Reativos para Diagnósticos do Instituto de Tecnologia em Imunobiológicos de Bio-Manguinhos, Antonio Ferreira, o teste garante total rastreabilidade e custa três a quatro vezes menos que os produtos similares comercializados por empresas privadas multinacionais. Até 2009, apenas dois laboratórios internacionais ofereciam o produto/serviço e a preços altos.
Segundo Ferreira, o Kit NAT foi desenvolvido para atender as necessidades e demandas da hemorrede pública brasileira. Com a produção em Bio-Manguinhos, o Ministério da Saúde terá uma economia em torno de US$ 28 milhões por ano. Uma rede centralizada em 14 serviços de hemoterapia, dotada de infraestrutura, equipamentos e profissionais capacitados, deverá processar a totalidade de amostras coletadas na hemorrede pública brasileira.
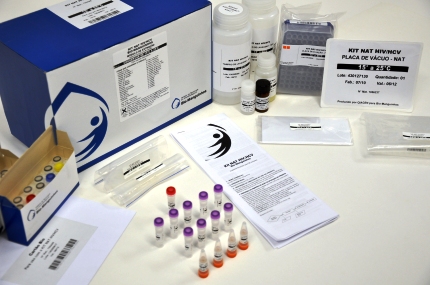
O Kit Nat tem capacidade de processamento que permite analisar, ao mesmo
tempo, até 552 bolsas de sangue por rotina - Imagem: Ascom / Bio-Manguinhos
“O produto é um exemplo da política afirmativa do Ministério da Saúde de investir em capacitação e acumulo de competências técnicas, nacionalização de insumos e produtos estratégicos e no fortalecimento do Complexo Industrial da Saúde. Oferecer um produto inovador a um custo viável significa também fomentar a política pública de autossuficiência em prevenção e diagnóstico, sem onerar os cofres do governo. Isso é resultado de um trabalho permanente para diminuir dependências tecnológicas e oferecer, cada vez mais, produtos estratégicos de excelente desempenho", afirma.
Mesmo sendo comparável aos melhores testes do mundo em precisão, profissionais de Bio-Manguinhos e do IBMP vêm trabalhando para tornar o Kit Nat ainda mais sensível, capaz de detectar mínimas frações de vírus. Num futuro próximo, o teste também deverá ser capaz de identificar nas bolsas de sangue os vírus da hepatite B (HBV) e da dengue.
Teste detecta sífilis em 15 minutos
Outra inovação de Bio-Manguinhos é o teste rápido Sífilis Duo, para detectar sífilis em cerca de 15 minutos. A tecnologia Dual Path Platform (DPP®) conjuga dois tipos de exames – triagem e confirmação – numa única plataforma tecnológica.
Antonio Ferreira explica que o teste detecta dois tipos de anticorpos produzidos em resposta à infecção do patógeno. A detecção isolada de um dos anticorpos pode sugerir uma cicatriz sorológica ou até uma infecção bastante recente e deve ser confirmada, mas a detecção de ambos anticorpos no soro do paciente indica infecção ativa e possibilita a imediata entrada no tratamento. O teste é capaz de fornecer resultados altamente sensíveis e específicos usando volumes mínimos de amostra.
Além do diagnóstico rápido e preciso, o teste permite fácil execução em campo, dispensa equipamentos e infraestrutura laboratorial e facilita o treinamento dos profissionais de saúde. A leitura é simples, pois os resultados podem ser obtidos tanto visualmente ou com a ajuda de um leitor portátil, e a interpretação destes resultados se dá pela presença ou ausência de bandas/linhas nas áreas de teste e controle.
A tecnologia é indicada para situações especiais, tais como a triagem da infecção em maternidades, Centros de Testagem e Aconselhamento, ações do Ministério da Saúde e para a ampliação da testagem em áreas remotas ou que não contam com uma estrutura laboratorial para o diagnóstico da sífilis. O teste Duo, de triagem e confirmação, está em processo de obtenção de registro e estará disponível ainda em 2014. Já o teste só de triagem vem sendo entregue regularmente ao Ministério da Saúde desde 2011 e é amplamente utilizado em todo território nacional.
“Produzindo e fornecendo um produto nacional, de qualidade superior e altamente confiável, Bio-Manguinhos espera contribuir para a ampliação e democratização do diagnóstico da infecção de sífilis e, desta forma, ajudar no combate a esta doença que, ainda nos dias atuais, é um grave problema de saúde pública”, afirma Ferreira.
Ele conta que os técnicos estão trabalhando em ensaios multiteste. “Atualmente estamos trabalhando para disponibilizar um novo formato de teste (multiplex) que contemple HIV e sífilis em um único procedimento. Este novo ensaio trará um diferencial muito interessante em vários aspectos, como o operacional, a facilidade para o usuário e uma redução de custos de transporte e armazenamento”, adianta. Outra vantagem dos testes multiplex é serem adaptáveis a diferentes tipos de fluidos corporais (sangue, soro, plasma ou saliva).
O teste de triagem treponêmico foi desenvolvido pela empresa norte americana Chembio Diagnostic Systems e adaptado as amostras brasileiras por Bio-Manguinhos em 2012. No momento encontra-se num processo de codesenvolvimento entre Chembio e Bio-Manguinhos. O multiteste combo (HIV + sífilis) deverá seguir a mesma dinâmica: desenvolvimento pela Chembio e adaptação para a realidade brasileira por Bio-Manguinhos.
Todas em um
O desenvolvimento de um multiteste para detecção de todas as doenças que precisam ser detectadas na triagem sorológica do sangue doado (HIV 1 e 2, HTLV I / II, sífilis, doença de Chagas, hepatite B e C) a partir de uma única amostra de sangue é o objetivo do projeto Microarranjos Líquidos, iniciado em 2008 no Instituto de Biologia Molecular do Paraná (IBMP) e Bio-Manguinhos. Fruto de pesquisas de mestrado e doutorado, o projeto foi fortemente apoiado pela Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, a Fiocruz, Hemobrás e, recentemente, pelo Funtec/BNDES. A plataforma utilizada permite um processamento rápido, com elevados níveis de sensibilidade e especificidade, de muitas amostras ao mesmo tempo – cerca de 90 – e com uma capacidade de multiplexidade elevada – de 50 a 100 doenças por ensaio.
De acordo com o vice-diretor da Fiocruz Paraná e coordenador de Gestão do IBMP, Mario S. Moreira, no momento, o projeto se divide em dois subprojetos. Um é a validação da plataforma por Bio-Manguinhos, a partir de um estudo piloto, a ser realizado provavelmente no Hemocentro de Belo Horizonte para, em seguida, se iniciar um estudo multicêntrico, em pelo menos três diferentes estados, quando então se prepara toda a documentação necessária para o registro do produto junto à Anvisa.
O outro subprojeto é desenvolvimento e validação das proteínas (antígenos) que comporão o teste pelo Instituto Carlos Chagas e o IBPM, já em fase final. “Cerca de 60% das proteínas já foram desenvolvidas e validadas em laboratório e agora seguem para Bio-Manguinhos desafiá-las na plataforma que será utilizada no campo. A expectativa é de que este produto seja comercializado a partir de 2015”, afirma.
Patógenos da sepse rastreados em menos de três horas
Iniciado em 2013 na Fiocruz Paraná por solicitação do Instituto Nacional do Câncer (Inca), como parte da cooperação entre as instituições, o projeto Sepsis é agora uma encomenda vertical do Ministério da Saúde, via Finep. O objetivo é desenvolver uma plataforma multiteste para o diagnóstico simultâneo dos principais patógenos associados à sepse no território nacional, com especificidade, sensibilidade e agilidade para orientar o manejo clínico dos pacientes sépticos nos hospitais, contribuindo para reduzir drasticamente os índices de morbidade e mortalidade nas unidades de terapia intensiva, e determinar ações de controle e vigilância epidemiológica de micro-organismos no ambiente hospitalar.
Mário Moreira explica que existem diversos estudos epidemiológicos publicados a respeito da sepse, e que os dados brasileiros são bastante preocupantes. De acordo com a Global Sepsis Alliance (GSA), ocorrem cerca de 30 milhões de novos casos por ano no mundo. No Brasil, estima-se que esse número seja em torno de 400 mil novos casos por ano, contribuindo para ocupação de 30 a 40% dos leitos de UTI disponíveis.
“O Brasil é um país com alta taxa de mortalidade quando comparado a outros países, conforme demonstrado no estudo Progress, realizado em 2009, que incluiu quase 12 mil pacientes. Pôde-se observar que a mortalidade brasileira é superior a 56% e só perde para mortalidade da Malásia”, revela. Segundo Moreira, há dois estudos brasileiros – o Bases, que incluiu cinco centros públicos e privados e mostrou uma mortalidade por sepse de 33,9%, por sepse grave de 46,9% e por choque séptico de 52,2% – e o Sepse Brasil, feito com 75 centros no país, e que confirmou esses dados de alta mortalidade.
“Para se ter ideia da gravidade da sepses, o risco de óbito aumenta em 7,6% para cada hora em que este paciente recebe o antimicrobiano inadequado. Se o tratamento correto for instituído nas primeiras horas após a instalação do quadro séptico, a chance de sobrevivência do paciente é de 80%. Entretanto, se a terapia antimicrobiana correta for instituída após 24 horas da instalação do quadro séptico, a chance de sobrevivência é de apenas 10%”, explica. De acordo com Moreira, o projeto encontra-se na fase inicial de desenvolvimento, com resultados bastante promissores e a expectativa de que o produto seja registrado na Anvisa em 2015, para então ser disponibilizado para o SUS.
Uma importante colaboração foi estabelecida com o Hospital das Clínicas (HC) da Universidade Federal do Paraná (UFPR). “Com recursos da Finep estamos modernizando os laboratórios de biologia molecular e microbiologia, nos quais parte dos estudos serão realizados. Pesquisadores e técnicos do HC estão diretamente envolvidos no projeto, o que é um diferencial importante para que o produto atenda plenamente as necessidades de um laboratório hospitalar”, esclarece.
A plataforma é constituída de um equipamento de execução do teste, um dispositivo de lavagem e secagem do biochip, um dispositivo de concentração e enriquecimento de amostras, o biochip e um software de integração, analise e emissão de resultados. “É uma plataforma concebida no conceito lab on a chip, flexível às mais diversas necessidades, dada a elevada capacidade de multiplexidade. O objetivo do projeto é fornecer um teste capaz de diagnosticar o agente causador da sepse em menos de três horas. Este tempo, aparentemente elevado, é bem menor do que o oferecido pelas tecnologias convencionais (hemocultura), que é de 24 a 48 horas, e com níveis de sensibilidade e especificidade bem abaixo do necessário”, explica.
O projeto reúne tecnologias que serão transferidas do exterior com tecnologias e inovações nacionais, fruto da parceria da Fiocruz Paraná com a empresa de equipamentos Lifemed, localizada no Rio Grande do Sul. A plataforma escolhida para este desenvolvimento do teste, In-Check (STMicroeletronics), combina dois métodos moleculares – PCR multiplex e microarranjo – o que permite a detecção e identificação de múltiplos alvos num único ensaio. Nas fases finais de desenvolvimento, dois hospitais da Fiocruz (Ipec e IFF), no Rio, o Grupo Hospitalar Conceição, em Porto Alegre, e o Instituto Nacional do Câncer participarão dos estudos multicentricos para validação do teste.
Multiteste para grávidas em meia hora
Outra inovação da Fiocruz Paraná é o projeto Rede Cegonha, este 100% nacional. Trata-se de um multiteste apresentado em duas versões: um lab on a chip capaz de diagnosticar até 20 doenças num só ensaio, a partir de uma amostra única de sangue, com resultados em cerca de 30 minutos, para ser usado nos consultórios médicos e postos de saúde que apoiam o programa Rede Cegonha e que necessitam realizar poucos testes diariamente; e um multiteste baseado na plataforma Luminex, com capacidade para realizar muitos testes ao mesmo tempo, para ser instalado nos hospitais que compõem a Rede Cegonha.
“O proposito é realizar o teste no momento do atendimento às mulheres grávidas, durante a realização das consultas para atendimento pré-natal. Com essa estratégia, o médico poderá receber os resultados do exame durante a consulta, o que facilita e torna mais eficaz a orientação terapêutica em caso de algum resultado positivo”, explica Moreira.
Inicialmente o multiteste esta sendo desenvolvido para diagnóstico de toxoplasmose, rubéola, citomegalovirose, sífilis, Aids e hepatites A, B e C. Principal fruto do INCT Diagnósticos, o projeto se iniciou em 2012, também financiado por uma encomenda vertical do Ministério da Saúde, por meio da Finep. O projeto já ultrapassou as fases de prova de conceito e está na fase de prototipagem dos dispositivos e validação das proteínas (antígenos). A previsão é que os produtos entrem em testes de campo (piloto e multicêntrico) no final de 2014, para registro em 2015.
Inovação em áreas de ponta como resposta aos desafios do SUS
De acordo com o vice-presidente de Produção e Inovação em Saúde da Fiocruz, Jorge Antonio Zepeda Bermudez, os reativos hoje colocados à disposição do Sistema Único de Saúde no Brasil representam a resposta da Fiocruz aos desafios que o SUS, maior sistema de acesso universal no mundo em desenvolvimento, enfrenta em seus 25 anos de existência. “Mais uma vez, Bio-Manguinhos e o ICC lideram no campo dos reativos para diagnóstico e mostram não apenas capacidade e compromisso, mas sobretudo que inovam em áreas de ponta”, afirma.
Fonte: Marina Lemle / Revista de Manguinhos


